Die Funktionen der Aminosäuren im menschlichen Körper und weitere Aspekte zu Aminosäuren
Veröffentlicht von Rainer Langlitz in Gesundheit · Sonntag, 09. Februar 2025 · 44:00
Tags: Aminosäuren, menschlicher, Körper, Mikronährstoffe, Funktionen, Bedeutung, Aspekte, Gesundheit, Ernährung, Biochemie, Fitness
Tags: Aminosäuren, menschlicher, Körper, Mikronährstoffe, Funktionen, Bedeutung, Aspekte, Gesundheit, Ernährung, Biochemie, Fitness
Inhalt
1. Einleitung (Einleitende Videos)
- Was sind Proteine?
- Was sind Aminosäuren?
2. Hauptteil
- Bezeichnung von Aminosäuren
- Proteinogene Aminosäuren
- Nicht-proteinogene Aminosäuren
- α-Aminosäuren
- L- bzw. D-Aminosäuren
- Essentielle bzw. nicht-essentielle sowie semi/bedingt-essentielle Aminosäuren
- Kanonische Aminosäuren
- Aminosäuren in Lebensmitteln
- Alle proteinogenen Aminosäuren auf einen Blick
- Kurzer Exkurs: "Botenstoffe und Enzyme"
- Neurotransmitter
- Hormone
- Wo entstehen die Hormone?
- Weitere Links über Hormone
- Beispiele für Hormone
- Einteilung der Hormone
- Enzyme
- Der genetische Code und das Prinzip der Codierung der Aminosäuren
- Zur Funktion einzelner Aminosäuren
- L-Arginin
- L-Cystein
- L-Glutamin
- Glycin
- Histidin
- Isoleucin
- Leucin
- L-Lysin
- Methionin
- L-Phenylalanin
- L-Prolin
- L-Tryptophan
- Tyrosin
- Valin
- Wann liegt ein Mangel vor? (Anzeichen für einen Aminosäuremangel)
- Wann sind Aminosäuren erhöht?
- Aminogramm: Was sind Normwerte für Aminosäuren?
- Wann bestimmt man Aminosäuren-Werte?
- Wann ist die Einnahme von Aminosäuren sinnvoll?
- Was ist zu beachten?
- Aminosäuren zum Abnehmen
- Link "Über die NetDoktor-Autoren"
- Weitere Informationen ("Allgemein - Gruppe 1 und 2")
3. Schlussteil / Abschließendes
1. Einleitung
Was sind Proteine?
Proteine (umgangssprachlich auch Eiweiße) sind Makromoleküle. In der Chemie und Biologie versteht man darunter große Moleküle, die aus vielen kleineren Bausteinen (Monomeren ) zusammengesetzt sind — in unserem Fall: den Aminosäuren. Davon gibt es 20 verschiedene Typen, die sich aber in ihrem Grundaufbau ähneln. Die unterschiedlichen Aminosäuren liegen in einem Protein miteinander verknüpft vor und bilden lange Ketten. Deren Größe kann sich mächtig unterscheiden: So besteht Insulin nur aus 51 Aminosäuren, während das Muskelprotein Titin aus um die 30.000 Aminosäuren aufgebaut ist. Proteine erfüllen in deinem Körper viele lebenswichtige Aufgaben — wie Transport, Regulation (z. B. Hormone), Gerüstfunktion und Beschleunigung chemischer Reaktionen (Enzyme)."
Was sind Aminosäuren?
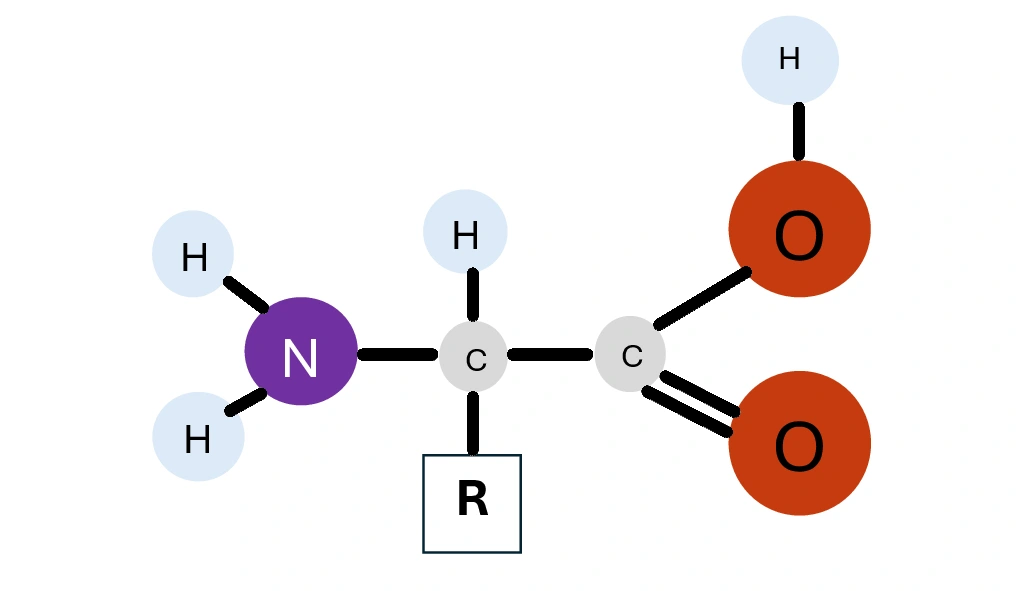
Aminosäuren sind - chemisch gesehen - organische Verbindungen mit einer Stickstoff (N) enthaltenden Aminogruppe (NH2) und einer Kohlenstoff (C) und Sauerstoff (O) enthaltenden Carbonsäure-bzw. Carboxylgruppe (COOH).
Aminosäuren sind die Grundbausteine unserer Proteine. Insgesamt gibt es über 270 bereits bekannte Aminosäuren. Davon sind nur 20 in unserem Erbgut gespeichert und bilden das Grundgerüst der Proteine. Deswegen heißen sie auch proteinogene Aminosäuren.
Die einzelnen Aminosäuren schließen sich zu einer langen Kette zusammen. Die Reihenfolge der verschiedenen Aminosäuren bestimmen die Proteinkette und damit die Eigenschaften des fertigen Proteins.
Aminosäuren sind in unserem Körper die Grundbausteine der Proteine. Dabei reihen sich die einzelnen Aminosäuren zu einer langen Kette aneinander und bilden das fertige Protein. Abhängig von der Zusammensetzung der Kette entstehen die unterschiedlichen Eiweiße. Doch nicht alle Aminosäuren, die wir benötigen, kann der Körper selbst herstellen. Manche müssen mit der Nahrung aufgenommen werden. Aminosäuren kommen in allen bekannten Lebewesen vor. Sie sind die Bausteine von Proteinen (Eiweiß) und werden frei bei der Zerlegung von Proteinen (Proteolyse).
Die einfachste Aminosäure, Glycin, konnte nicht nur auf der Erde, sondern auch auf Kometen, Meteoriten und in Gaswolken im interstellaren Raum nachgewiesen werden. [...]
1. Hauptteil
1. Bezeichnung von Aminosäuren
Als Protein sind die Aminosäuren an nahezu allen lebenswichtigen Prozessen beteiligt. Im menschlichen Körper erfüllen die Aminosäuren wichtige Funktionen:
- Bildung der Proteine
- Deckung des Energiebedarfs
- Aufbau der Haut
- Aufbau der Muskulatur
- Regulation und Unterstützung des Immunsystems
- Übertragung von Signalen im Gehirn (Neurotransmitter)
- Transport und Speicherung von Nährstoffen
- Ausgangssubstanzen für einige Hormone, z.B. Schilddrüsenhormone
- Aufbau der Zellen
- Aufbau von Knochen
- Regulation des Herz-Kreislaufsystems
In Form von Proteinen sind Aminosäuren wichtige funktionelle und strukturelle Komponenten des Körpers. Sie dienen beispielsweise als Enzyme den Stoffwechselprozessen oder als Abwehrproteine dem Immunsystem. Außerdem findest du sie als Teil der Nahrung, wobei sie für die Deckung des täglichen Energiebedarfs wichtig sind.
Fehlen dem Körper wichtige Grundbausteine, dann kann das Auswirkungen auf viele Prozesse im Körper haben. Unter anderem auf das Immunsystem, die Leistungsfähigkeit oder den Fettstoffwechsel.
1.a) Proteinogene Aminosäuren
Als proteinogene Aminosäuren werden Aminosäuren bezeichnet, die in Lebewesen als Bausteine der Proteine während der Translation nach Vorgabe genetischer Information verwendet werden. Bei der Biosynthese von Proteinen, die an den Ribosomen einer Zelle stattfindet, werden im Zuge der Proteinbiosynthese ausgewählte Aminosäuren durch Peptidbindungen in bestimmter Reihenfolge zur Polypeptidkette eines Proteins verknüpft. Die Aminosäurensequenz des ribosomal gebildeten Peptids wird dabei vorgegeben durch die in der Basensequenz einer Nukleinsäure enthaltene genetische Information, wobei nach dem genetischen Code eine Aminosäure durch ein Basentriplett codiert wird.
Die proteinogenen Aminosäuren sind stets α-Aminosäuren. Bis auf die kleinste, Glycin, sind sie chiral und treten mit besonderer räumlicher Anordnung auf.[13] Eine Besonderheit weist die Aminosäure Prolin auf, deren Aminogruppe ein sekundäres Amin besitzt und die sich daher nicht so flexibel in eine Proteinfaltung einfügt wie andere proteinogene Aminosäuren – Prolin gilt beispielsweise als Helixbrecher bei α-helikalen Strukturen in Proteinen. Aufgrund der sekundären Aminogruppe wird Prolin auch als sekundäre Aminosäure – öfters fälschlicherweise bzw. veraltet auch als Iminosäure – bezeichnet.
1.b) Nicht-proteinogene Aminosäuren
Neben den proteinogenen Aminosäuren gibt es auch nicht-proteinogene Aminosäuren. Das Spektrum der Aminosäuren geht also über diese rund 20 proteinogenen Aminosäuren weit hinaus. So sind bisher über 400 nicht-proteinogene natürlich vorkommende Aminosäuren bekannt, die biologische Funktionen haben. Sie sind nicht in unserem Erbgut gespeichert und deshalb auch kein Grundbaustein der Proteine. Dafür haben sie andere Funktionen. Sie dienen zum Beispiel als Vorläufer von Hormonen oder Neurotransmittern.
Die vergleichsweise seltenen D-Aminosäuren stellen hierbei eine spezielle Gruppe dar. Die Vielfalt der synthetisch erzeugten und die der theoretisch möglichen Aminosäuren ist noch erheblich größer.
1.c) α-Aminosäuren
Zur Klasse der Aminosäuren zählen organische Verbindungen, die zumindest eine Aminogruppe (–NH2 bzw. substituiert –NR2) und eine Carboxygruppe (–COOH) als funktionelle Gruppen enthalten, also Strukturmerkmale der Amine und der Carbonsäuren aufweisen. Chemisch lassen sie sich nach der Stellung ihrer Aminogruppe zur Carboxygruppe unterscheiden – steht die Aminogruppe am Cα-Atom unmittelbar benachbart zur endständigen Carboxygruppe, nennt man dies α-ständig und spricht von α-Aminosäuren. Ausgewählte α-Aminosäuren sind die natürlichen Bausteine von Proteinen. Sie werden miteinander zu Ketten verknüpft, indem die Carboxygruppe der einen Aminosäure mit der Aminogruppe der nächsten eine Peptidbindung eingeht. Die auf diese Weise zu einem Polymer verketteten Aminosäuren unterscheiden sich in ihren Seitenketten und bestimmen zusammen die Form, mit der das Polypeptid im wässrigen Milieu dann zum nativen Protein auffaltet. Diese Biosynthese von Proteinen findet in allen Zellen an den Ribosomen nach Vorgabe genetischer Information statt, die in Form von mRNA vorliegt.
1.d) L- bzw. D-Aminosäuren
Befindet sich die Aminogruppe (NH2) links wird die Aminosäure als L-Aminosäure (lat. laevus „links“) bezeichnet
Befindet sie sich die Aminogruppe (NH2) rechts, wird sie als D-Aminosäure (lat. dexter „rechts“) bezeichnet.
Proteinogene Aminosäuren, solche die die Proteine bilden, sind L-Aminosäuren, d. h. nur die L-Aminosäuren sind proteinogen.
Dennoch kommen in Lebewesen vereinzelt auch D-Aminosäuren vor. Diese werden jedoch unabhängig von proteinogenen Stoffwechselwegen synthetisiert und dienen nicht dem ribosomalen Aufbau von Proteinen. So wird zum Beispiel D-Alanin in Peptidoglycane der bakteriellen Zellwand eingebaut oder D-Valin in bakterielle Cyclo-Depsipeptide wie Valinomycin. Verschiedene Arten von Archaeen, Bakterien, Pilzen und Nacktkiemern verfügen über nichtribosomale Peptidsynthetasen genannte Multienzymkomplexe, mit denen solche (nichtproteinogenen) Aminosäuren in ein nichtribosomales Peptid eingebaut werden können.
1.e) Essentielle bzw. nicht-essentielle sowie semi/bedingt-essentielle Aminosäuren
Aminosäuren, die ein Organismus benötigt, jedoch nicht selbst herstellen kann, heißen essentielle Aminosäuren und müssen mit der Nahrung aufgenommen werden. Alle diese essentiellen Aminosäuren sind L-α-Aminosäuren. Für Menschen sind Valin, Methionin, Leucin, Isoleucin, Phenylalanin, Tryptophan, Threonin und Lysin essentielle Aminosäuren. Seit 1985 wird von der WHO auch die Aminosäure Histidin als essenzielle Aminosäure eingestuft. Es gibt somit neun essenzielle Aminosäuren.[25] Bedingt essentielle oder semi-essentielle Aminosäuren müssen nur in bestimmten Situationen mit der Nahrung aufgenommen werden, zum Beispiel während des Wachstums oder nach schweren Verletzungen. Die übrigen Aminosäuren werden entweder direkt synthetisiert oder aus anderen Aminosäuren durch Modifikation gewonnen. So kann Cystein aus der essentiellen Aminosäure Methionin synthetisiert werden. Solange das Vermögen, aus Phenylalanin die Aminosäure Tyrosin herzustellen, noch nicht ausgereift ist, zählt auch diese neben den anderen zu den essentiellen Aminosäuren im Kindesalter. Aus ähnlichem Grund muss auch bei einer Phenylketonurie Tyrosin zugeführt werden. Daneben gibt es andere Erkrankungen, die den Aminosäurestoffwechsel beeinträchtigen und die Aufnahme einer eigentlich nicht-essentiellen Aminosäure unter Umständen erfordern.
Essentielle Aminosäuren:
Von allen 20 proteinogenen Aminosäuren gibt es 8 "essentielle Aminosäuren". Sie zeichnen sich dadurch aus, dass der Körper sie nicht selbst herstellen kann. Die essentiellen Aminosäuren müssen also durch die Nahrung aufgenommen werden. Dazu gehören die acht Aminosäuren Isoleucin (1), Leucin (2), Lysin (3), Methionin (4), Phenylalanin (5), Threonin (6) und Tryptophan (7) und Valin (8).
Isoleucin (1): Es ist am Muskelstoffwechsel und Immunfunktionen beteiligt. Außerdem hilft Isoleucin bei der Bildung von Hämoglobin und der Energieregulierung.
Leucin (2): Diese Aminosäure unterstützt den Körper unter anderem bei der Produktion von Wachstumshormonen, bei der Reparatur von Muskelgewebe, der Wundheilung und der Regulierung des Blutzuckerspiegels.
Lysin (3): Lysin ist an der Produktion von Hormonen und Energie beteiligt. Es ist auch wichtig für die Kalziumaufnahme und die Immunfunktion.
Methionin (4): Diese essenzielle Aminosäure unterstützt das Wachstum von Gewebe, den Stoffwechsel und die Entgiftung. Zudem hilft sie bei der Aufnahme essentieller Mineralstoffe wie Zink und Selen.
Phenylalanin (5): Der Körper braucht diese Aminosäure für die Produktion von Botenstoffen des Gehirns, einschließlich Dopamin, Epinephrin und Norepinephrin. Außerdem ist Phenylalanin wichtig für die Produktion einer weiteren Aminosäure (Tyrosin).
Threonin (6): Diese Aminosäure ist ein Bestandteil von Kollagen und Elastin – Proteine, die der Haut und dem Bindegewebe Struktur geben. Sie helfen aber auch bei der Blutgerinnung. Threonin spielt außerdem eine wichtige Rolle im Fettstoffwechsel und in der Immunfunktion.
Tryptophan (7): Tryptophan trägt dazu bei, das richtige Stickstoffgleichgewicht im Körper aufrechtzuerhalten. Es hilft auch bei der Bildung von Serotonin. Dieser Gehirn-Neurotransmitter reguliert die Stimmung, den Appetit und den Schlaf.
Valin (8): Diese Aminosäure ist an Muskelwachstum, Geweberegeneration und Energieerzeugung beteiligt.
Link und Quellenangabe:
Nicht-Essentielle Aminosäuren:
Außerdem gibt es die 10 "nicht-essentiellen Aminosäuren". Diese nicht-essentiellen Aminosäuren können vollständig vom Körper produziert werden: Alanin (1), Asparagin (2), Asparaginsäure (3), Cystein (4), Glutamin (5), Glutaminsäure (6), Glycin (7), Prolin (8), Serin (9) und Tyrosin (10).
Alanin (1): Diese Aminosäure fungiert als Transportmolekül für Aminostickstoff im Blut. Darüber hinaus verwendet der Körper Alanin für die Neubildung von Glukose (Gluconeogenese), die hauptsächlich in der Leber stattfindet.
Asparagin (2): Seine Bedeutung liegt unter anderem darin, dass der Körper daraus Aspartat (siehe unten) gewinnen kann.
Asparaginsäure (oder Aspartat) (3): Sie dient zum Beispiel als Nervenbotenstoff (Neurotransmitter) im Gehirn. Außerdem verwendet der Körper Aspartat, um weitere Aminosäuren herzustellen (z.B. Asparagin).
Glutamin (5): Diese Aminosäure hat unter anderem eine sehr große Bedeutung für Immunzellen.
Glutaminsäure (oder Glutamat) (6): Wie Aspartat spielt Glutamat unter anderem eine Rolle als Hirn-Botenstoff und als Ausgangssubstrat für weitere Aminosäuren (wie Prolin).
Glycin (7): Glycin ist zum Beispiel an Entgiftungsreaktionen in der Leber, am Aufbau von DNA (Speicher der Erbinformation) und Kollagen (wichtiges Strukturprotein) sowie an der Bildung von Hämoglobin (roter Blutfarbstoff) beteiligt.
Prolin (8): Zu den Aufgaben dieser Aminosäure gehört es unter anderem, zu einem stabilen Bindegewebe beizutragen.
Serin (9): Indem Serin an verschiedene Enzyme bindet, werden diese entweder aktiviert oder inaktiviert. Des Weiteren dient die Aminosäure zum Beispiel als Baustein von Phosphatidylserin (ein Bestandteil der Zellmembran).
Sonderaminosäuren
Davon nehmen vier Aminosäuren eine Sonderposition ein:
Cystein (4) und Tyrosin (10) sind "semi-essentielle" bzw. "bedingt-essentielle" Aminosäuren: Der Körper kann sie zwar selbst herstellen, womit sie nicht-essentiell sind. Für die Herstellung braucht der Körper aber essentielle Aminosäuren.
Cystein nutzt der Körper beispielsweise, um Taurin herzustellen. Diese nicht-proteinogene Aminosäure kann unter anderem Zellschäden durch aggressive Sauerstoffverbindungen (freie Radikale) vorbeugen, Entzündungsreaktionen hemmen und bestimmte Immunzellen aktivieren.
Tyrosin dient unter anderem als Ausgangsstoff für verschiedene Nervenbotenstoffe und Hormone wie Dopamin, Adrenalin, Endorphine und Schilddrüsenhormone.
Neben den essentiellen Aminosäuren gibt es zudem die 2 "semi-essentiellen Aminosäuren" . Der Körper kann sie zwar selbst produzieren, jedoch in einigen Situation nicht in ausreichender Menge. Reicht die Eigensynthese nicht aus, müssen sie über die Nahrung dem Körper zugeführt werden. Zu ihnen gehören: Arginin (1) und Histidin (2).
Arginin (1) und Histidin (2) sind bedingt-essentielle Aminosäure: Eigentlich kann der Körper sie selbst herstellen. Diese Eigenproduktion reicht aber in besonderen Situationen (z.B. während der Schwangerschaft) nicht aus, um den Bedarf zu decken. Dann werden Histidin und Arginin zu essenziellen Aminosäuren, die mit der Nahrung zugeführt werden müssen.
Histidin hilft bei der Bildung eines Gehirn-Neurotransmitters Histamin. Dieser spielt eine wichtige Rolle für Immunfunktion, Verdauung, Schlaf und Sexualfunktion.
Arginin ist unter anderem deshalb wichtig, weil der Körper daraus Polyamine wie Spermidin herstellt. Diese stabilisieren die Struktur der DNA (Speicher der Erbinformation)."
Zitat Ende.
Link und Quellenangabe:
1.f) Kanonische Aminosäuren
Für 20 der proteinogenen Aminosäuren finden sich Codons in der (am häufigsten gebrauchten) Standardversion des genetischen Codes, d. h. durch die genetischen Codons in der DNA werden 20 Aminosäuren kodiert, aus denen sich die Proteine zusammensetzen. Diese 20 Aminosäuren werden als kanonische Aminosäuren oder Standardaminosäuren bezeichnet.
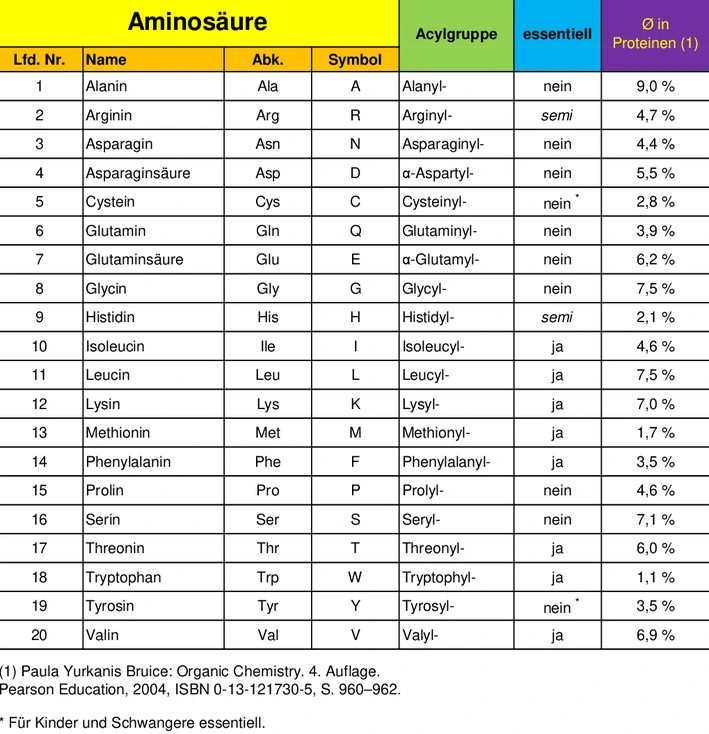
In Aminosäuresequenzen werden die Aminosäuren meist mit einem Namenskürzel im Dreibuchstabencode angegeben oder im Einbuchstabencode durch ein Symbol dargestellt.[16]
Der Einbuchstabencode wurde von IUPAC-IUB auf Grundlage der folgenden Regeln gewählt:[17]
- Wo keine Mehrdeutigkeit besteht, wurden die Anfangsbuchstaben verwendet: C Cystein, H Histidin, I Isoleucin, M Methionin, S Serin, V Valin,[17]
- Wenn eine willkürliche Zuordnung erforderlich ist, haben die strukturell einfacheren Aminosäuren Vorrang: A Alanin, G Glycin, L Leucin, P Prolin, T Threonin,[17]
- F PHenylalanin und R Arginin aRginine wurden phonetisch suggestiv zugeordnet,[17]
- W Tryptophan wurde zugeordnet da der Doppelring optisch an den sperrigen Buchstaben W erinnert,[17]
- K Lysin und Y Tyrosin wurden aufgrund der alphabetischen Nähe zu ihren Initialen L und T zugeordnet (dabei ist zu beachten, dass U wegen der Ähnlichkeit mit V vermieden wurde, während X für unbestimmte oder atypische Aminosäuren reserviert wurde); für Tyrosin wurde zudem die Merkhilfe tYrosine vorgeschlagen,[18]
- D Aspartat wurde willkürlich zugeordnet, wobei als Merkhilfe asparDic acid vorgeschlagen wurde;[19] E Glutamat wurde in alphabetischer Reihenfolge zugeordnet, da es lediglich um eine Methylen –CH2– Gruppe größer ist,[18]
- N Asparagin wurde willkürlich zugeordnet, wobei als Merkhilfe asparagiNe vorgeschlagen wurde;[19] Q Glutamin wurde in alphabetischer Reihenfolge zugeordnet von den noch verfügbaren Buchstaben (zu beachten ist, dass O aufgrund der Ähnlichkeit zu D vermieden wurde), mit der vorgeschlagenen Merkhilfe Qlutamine."
Zitat Ende.
Link und Quellenangabe:
2.) Aminosäuren in Lebensmittel
Aminosäuren kommen überwiegend als Bestandteile von Proteinen in Lebensmitteln vor. So wird ihr Bedarf größtenteils über die tägliche Proteinzufuhr gedeckt. Die Empfehlungen liegen hier bei ca. 0,8 Gramm Protein pro Kilogramm Körpergewicht.
Nur in geringer Menge sind sie in freier Form in den Lebensmitteln vorhanden. Ein Beispiel für eine freie Aminosäure in der Nahrung ist Glutaminsäure. Ihr Salz Glutamat wird häufig als Geschmacksverstärker eingesetzt.
Die essentiellen Aminosäuren müssen über die Nahrung aufgenommen werden.
Eine unausgewogene Ernährung kann zu einem Mangel der essentiellen Aminosäuren führen. Auf Dauer kann das viele negative Folgen auf den Körper haben. Ein Mangel der Aminosäuren Valin kann beispielsweise zu Abgeschlagenheit, einem vermehrten Muskelabbau oder zu einer Berührungsüberempfindlichkeit führen.
3.) Alle proteinogenen Aminosäuren auf einen Blick
Hier ist ein kurzer Überblick über alle proteinogenen Aminosäuren in unserem Körper:
- Alanin
- Asparagin
- Asparaginsäure
- Cystein
- Glutamin
- Glutaminsäure
- Glycin
- Prolin
- Serin
- Tyrosin
- Arginin
- Histidin
- Isoleucin
- Leucin
- Valin
- Lysin
- Methionin
- Phenylalanin
- Threonin
- Tryptophan
4.) Kurzer Exkurs: "Botenstoffe und Enzyme"
Es gibt Aminosäuren, die als Vorläufer von Hormonen und Neurotransmittern wirken.
Dabei spielen einige Aminosäuren als Neurotransmitter eine besondere Rolle, ebenso verschiedene Abbauprodukte von Aminosäuren; biogene Amine treten nicht nur als Botenstoffe im Nervensystem auf, sondern entfalten auch als Hormone und Gewebsmediatoren vielfältige physiologische Wirkungen im Organismus.Einige Aminosäuren spielen als Neurotransmitter eine besondere Rolle, ebenso verschiedene Abbauprodukte von Aminosäuren; biogene Amine treten nicht nur als Botenstoffe im Nervensystem auf, sondern entfalten auch als Hormone und Gewebsmediatoren vielfältige physiologische Wirkungen im Organismus.
Botenstoffe sind alle chemischen Stoffe, die bei Lebewesen der Signalübertragung oder chemischen Kommunikation (Chemokommunikation) dienen. Solche können dabei ihre Wirkung sowohl innerhalb eines einzelnen Organismus entfalten
Beispiele: Hormone und Neurotransmitter
5.a) Neurotransmitter
Während Neurotransmitter für eine schnelle Reizweiterleitung bzw. –blockade im Nervensystem sorgen, vermitteln Hormone ihre Wirkung über die Blutbahn an die weiter entfernten Zielorgane.
5.b) Hormone
Hormone: Hormone werden in endokrinen Drüsen produziert und in den Blutkreislauf abgegeben. Neurotransmitter: Neurotransmitter werden von präsynaptischen Nervenenden in die Synapse abgegeben. Hormone: Hormone werden über das Blut übertragen. Neurotransmitter: Neurotransmitter werden über den synaptischen Spalt übertragen.
Neurotransmitter und Neurohormone. Das sind Botenstoffe, die von Nervenzellen, unter anderem im Gehirn, ausgeschüttet werden. Der Unterschied zwischen Transmitter und Hormon liegt hierbei in der Reichweite: Neurotransmitter übertragen Signale auf kurzem Weg direkt zwischen den Nervenzellen, Neurohormone werden mit dem Blut transportiert und können so auch längere Wege zurücklegen. Viele Stoffe können sowohl als Transmitter als auch als Hormon wirken.
5.c) Wo entstehen die Hormone?
Die meisten Hormone werden von sogenannten endokrinen Drüsen gebildet, die ihre Stoffe direkt ins Blut abgeben. Über den Kreislauf erreichen sie die Stellen im Körper, an denen sie wirken sollen.
Wichtige endokrine Drüsen sind:
- Bauchspeicheldrüse
- Keimdrüsen (Hoden und Eierstöcke)
- Schilddrüse
- Nebenschilddrüsen
- Nebennieren
- Hirnanhangdrüse (Hypophyse)
5.d) Weitere Links über Hormone
Das Hormonsystem - So steuern Hormone unser Verhalten und unsere Gefühle | Wissen ist gesund
Im Reich der Hormone - Mythos und Wirklichkeit | Doku HD Reupload | ARTE
Vermögen verschenken, keine Muttergefühle - Wie Hormone uns steuern | SWR Doku
5.e) Beispiele für Hormone
- Insulin und Glukagon
- Adrenalin, Noradrenalin und Acetylcholin
- Melatonin und Cortisol
- Testosteron
- Östrogen
- Erythropoetin (EPO)
- Schilddrüsenhormone T3 und T4
- Somatotropes Hormon (auch Somatotropin)
- Leptin
- Ghrelin
5.f) Einteilung der Hormone
Nach chemischer Klassifikation
- Protein- und Peptidhormone mit charakteristischer Aminosäuresequenz
- Neuropeptide des Hypothalamus:
- Freisetzungshormone für LH/FSH, TSH, ACTH, GH
- Somatostatin
- Agouti-ähnliches Peptid (AgRP)
- Neuropeptid Y (NPY)
- Leptin
- Ghrelin
- Glykoproteinhormone der Adenohypophyse:
- Follikelstimulierendes Hormon (Follitropin, FSH)
- Luteinisierendes Hormon (Luteotropin, LH)
- Thyreoidea-stimulierendes Hormon (Thyreotropin, TSH)
- Adrenocorticotropes Hormon (Adrenocorticotropin, ACTH)
- weitere adenohypophysäre Hormone:
- Somatropin (GH)
- Prolaktin
- Melanozyten-stimulierendes Hormon (MSH)
- Galanin
- Kisspeptin
- Neuropeptide der Neurohypophyse:
- Antidiuretisches Hormon (Adiuretin, Vasopressin, ADH)
- Oxytocin
- Hormone der Schilddrüsen
- Calcitonin
- Hormone der Nebenschilddrüsen
- Parathormon (PTH)
- Hormon des Herzen
- Atriales natriuretisches Peptid (ANP)
- Hormone der pankreatischen Inselzellen:
- Insulin
- Glucagon
- Somatostatin
- Pankreatisches Hormon (PP)
- Peptidhormone des Magen- und Darmtraktes
- Cholecystokinin (CCK)
- Sekretin
- Gastrin
- Ghrelin
- Vasoaktives intestinales Peptid (VIP)
- Glukoseabhängiges insulinotropes Peptid (GIP)
- Peptid YY (PYY)
- Peptidhormon der Leber
- Insulinähnliche Wachstumsfaktoren (Somatomedine, IGF)
- Proteinhormone der Gonaden
- Inhibin und Activin
- Protein/Peptid-Hormone bei Vertebraten, nicht beim Menschen gefunden
- bei Lurchen
- Caerulein
- bei Fischen
- Stanniokalzin; jetzt auch beim Menschen (und weiteren Vertebraten) zwei Stanniokalzine mit noch unbekannter Funktion gefunden
- Aminosäurederivate
- Katecholamine
- Adrenalin
- Noradrenalin
- Thyroxin (T4) und Triiodthyronin (T3)
- Serotonin
- Melatonin
- Histamin
- Isoprenderivate – wie Juvenilhormon und Neotenin bei Insekten
- Steroidhormone – wie die Nebennierenrinden- und Geschlechtshormone
- Mineralocorticoide – wie Aldosteron
- Glucocorticoide – wie Cortisol
- Estrogene – wie Estradiol
- Gestagene – wie Progesteron
- Androgene – wie Testosteron
- Dehydroepiandrosteron (DHEA)
- Arachidonsäurederivate (Eicosanoide)
- Prostaglandine
- Leukotriene
- Thromboxane
5.g) Enzyme
Enzyme spalten Eiweiße in einzelne Aminosäuren, Kohlenhydrate als Mehrfachzucker in Einfachzucker und Fette in Fettsäuren. Diese kann der Darm aufnehmen und dem Körper dann als Baustein und Energiequelle zur Verfügung stellen.
Der Verdauungsprozess umfasst insgesamt die Zerkleinerung, die enzymatische Spaltung und die Aufnahme der Nahrungsbestandteile ins Blut. Eine wichtige Rolle spielen dabei Mund, Speiseröhre, Magen, Darm, Leber, Gallenblase und die Bauchspeicheldrüse. Im gesamten Magen-Darm-Trakt befindet sich ein spezielles Nervensystem, das die Produktion der Verdauungssäfte sowie die Organbewegungen steuert.
Ein Enzym, auch Ferment genannt, ist ein Stoff, der aus biologischen Großmolekülen besteht und als Katalysator bestimmte chemische Reaktionen beschleunigen kann. Die katalysierte Reaktion kann zwar prinzipiell auch ohne das jeweilige Enzym ablaufen, doch sehr viel langsamer.[1] Die meisten Enzyme sind Proteine; gebildet werden sie in der Zelle wie die meisten anderen Proteine über die Proteinbiosynthese an den Ribosomen, auch die nichtribosomalen Peptidsynthetasen. Ausnahmen hiervon sind Nukleinsäuren mit katalytischer Aktivität, so natürlich vorkommende RNA wie snRNA als Ribozym oder künstlich hergestellte katalytisch aktive DNA (Desoxyribozym).
Enzyme haben wichtige Funktionen im Stoffwechsel von Organismen. Mit der enzymatischen Katalyse regulieren Zellen Energiefluss und Umsatz über die von ihnen bevorzugten Stoffwechselwege. Enzyme steuern den überwiegenden Teil biochemischer Reaktionen – von der Transkription (RNA-Polymerase) und der Replikation (DNA-Polymerase) der Erbinformationen bis hin zur Verdauung.
Exkurs Ende.
5.) Der genetische Code und das Prinzip der Codierung der Aminosäuren:
Zitat:
"Als „genetischer Code“ werden die Regeln bezeichnet, aufgrund derer die DNA-Sequenz (d.h. die Abfolge der Basen in der DNA) in eine Aminosäuresequenz übersetzt wird. Eine bestimmte Abfolge von drei DNA-Basen kodiert für eine bestimmte Aminosäure. Aminosäuren sind die Bausteine der Proteine."
Zitat Ende.
Link und Quellenangabe:
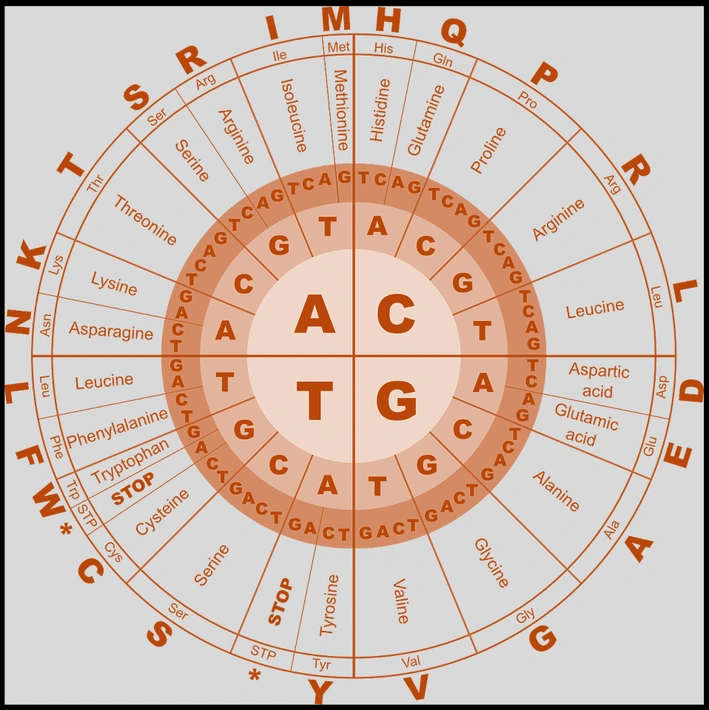
Abfolgen von Nukleinbasen codieren für Aminosäuren. Dazu werden jeweils Basen-Tripletts betrachtet - diese drei Nukleotide hintereinander nennt man Codon. Sie stehen für eine Aminosäure. Insgesamt gibt es 64 Codons, 61 davon können in Aminosäuren übersetzt werden.
Zum Beispiel codiert die Abfolge GUC für die Aminosäure Valin. Genauso steht aber auch GUG für Valin. Mehrere Codons codieren also für die gleiche Aminosäure, weshalb man den genetischen Code auch als degeneriert bezeichnet.
Die vielen Kombinationen muss man sich natürlich nicht alle merken: Die verschiedenen Sequenzen werden in der Codesonne zusammengefasst.
Link und Quellenangabe:
(Codesonne siehe Bild oben).
Dargestellt werden die Aminosäuren jeweils als Kombination aus drei Nukleotiden mit je vier möglichen Basen, so dass es 64 Kombinationen gibt.
Es gibt vier Nukleotide:
Adenin und Thymin.
Cytosin und Guanin.
Die Code-Sonne bei Wikipedia:
Aminosäuren sind die Bausteine der Proteine. Somit kann aus einem DNA-Abschnitt (einem Gen) der Bauplan eines Proteins abgelesen und umgesetzt werden.
Die Basensequenz der mRNA codiert in Tripletts die Aminosäurensequenz, wobei jeweils ein Basentriplett ein Codon darstellt, das für eine bestimmte proteinogene Aminosäure steht. Die hiermit als Bausteine für die Bildung von Proteinen in einer bestimmten Reihenfolge angegebenen Aminosäuren formen die Proteine. Beim Menschen sind es 21 verschiedene proteinogene Aminosäuren, neben den standardmäßig 20 (kanonischen) Aminosäuren auch Selenocystein. Nach der Translation können die Seitenketten einiger im Protein eingebauter Aminosäuren noch modifiziert werden.
6.) Zur Funktion einzelner Aminosäuren
6.a) Funktion von L-Arginin
Zitat aus Wikipedia, Art. Arginin, Aufruf vom 09.02.2025:
"Die hauptsächliche Funktion von L-Arginin liegt in der Verwendung zum Aufbau von Proteinen. In Pflanzen-Keimlingen und Speicherzellen dient L-Arginin als Reservoir für organischen Stickstoff. L-Arginin dient als Vorläufer bei der Synthese von Kreatin, das in Form von Kreatinphosphat ein wichtiger Energiespeicher bei Wirbeltieren ist. L-Arginin ist ein Metabolit des Harnstoffzyklus, in dem das Ammonium, das beim Abbau von Stickstoffverbindungen (z. B. Aminosäuren) entsteht, in Harnstoff umgewandelt wird. Durch Decarboxylierung kann L-Arginin in Agmatin und weiter in Polyamine umgewandelt werden, die in der Zelle essentielle Funktionen bei der Stabilisierung von DNA, RNA und Membranen haben. L-Arginin ist beim Menschen und bei vielen anderen Tieren die alleinige Vorstufe von Stickstoffmonoxid (NO), einem der kleinsten Botenstoffe im menschlichen Körper. Durch NO-Synthasen (Stickstoffmonoxid-Synthasen) entstehen aus L-Arginin der Endothelium-derived relaxing Factor (EDRF), der als NO identifiziert wurde. EDRF führt physiologisch zu einer Gefäßerweiterung, indem das NO in die Muskelschicht der Gefäße diffundiert. Es aktiviert dort die lösliche Guanylatcyclase und führt so zur Erschlaffung der glatten Muskulatur und zum Nachlassen des Gefäßtonus. Studien zeigen, dass Arginin über diese Gefäßerweiterung einen erhöhten Blutdruck signifikant senken kann.[17]
Aufgrund der gefäßerweiternden Funktion findet Arginin im Bodybuilding als sogenanntes „Pump-Supplement“ Anwendung. Weiterhin führt das NO zur Hemmung der Thrombozytenaggregation und -adhäsion. Dadurch wird die Bereitschaft für thrombotische Veränderungen an Gefäßplaque-Rupturen herabgesetzt, dem häufigsten Grund für zerebrale Insulte (Schlaganfall). Es wird angenommen, dass Arginin die unterdrückte Immunantwort bei schweren Verletzungen, Mangelernährung, Sepsis und nach Operationen positiv beeinflussen kann. Bei zusätzlicher Gabe werden eine verbesserte zelluläre Immunantwort, eine Abnahme verletzungsbedingter Funktionsstörungen der T-Zellen und eine verstärkte Phagozytose beobachtet. Zusätzlich wird die Ausbildung der endothelialen Dysfunktion (gestörten Gefäßfunktion) verhindert.[18][19]
1998 erhielten die Wissenschaftler Robert F. Furchgott, Louis J. Ignarro und Ferid Murad für die Erforschung des Zusammenhangs von Arginin und dem körpereigenen sekundären Botenstoff Stickstoffmonoxid (Stickoxid, NO) den Nobelpreis für Medizin.
Neue Studien zeigen zudem, dass eine Supplementation mit Arginin die Freisetzung von Insulin aus den beta-Zellen des Pankreas fördern kann und gleichzeitig die Insulinresistenz signifikant verringert.[20][21] Neben der positiven Wirkung von L-Arginin auf die Glucosetoleranz sowie auf Insulinsensitivität und -produktion führt eine L-Arginin-Supplementation zusätzlich zu einem verbesserten antioxidativen Status.[22]
Arginin antagonisiert die gefährlichen Wirkungen von asymmetrischem Dimethylarginin (ADMA) auf die Blutgefäße. ADMA entkoppelt die Stickstoffmonoxid-Bildung, wodurch eine endotheliale Dysfunktion mit nitrosativem und oxidativem Stress ausgelöst wird."
Zitat Ende.
Link und Quellenangabe:
Zitat aus Wikipedia, Art. Cystein, Aufruf vom 09.02.2025:
"Aus L-Cystein werden pharmazeutische Wirkstoffe im industriellen Maßstab hergestellt, z. B. (R)-S-Carboxymethylcystein und (R)-N-Acetylcystein (NAC). Diese beiden Pharmawirkstoffe sollen als orale Mukolytika den oft zähen Bronchialschleim bei chronischer Bronchitis und chronisch obstruktiver Lungenerkrankung verflüssigen. Unter der Gabe von Cystein wird der im Verlauf dieser Erkrankungen vermehrt gebildete Bronchialschleim dünnflüssiger und kann so leichter abgehustet werden. Cystein steigert auch eine Reihe von Lymphozytenfunktionen, wie beispielsweise die zytotoxische T-Zellaktivität. Cystein und Glutathion verhindern die Expression von NF-AT, des nukleären Transkriptionsfaktors in stimulierten T-Zell-Linien. In-vitro-Studien zeigen, dass die stimulierende Wirkung von TNF (Tumornekrosefaktor), induziert durch freie Radikale, auf die HIV-Replikation in Monozyten durch schwefelhaltige Antioxidantien gehemmt werden kann. Diese grundlegenden Studien sprechen dafür, dass die Behandlung von Entzündungskrankheiten und AIDS mit Cystein damit möglicherweise nützlich sein könnten.
Cystein kann Schwermetall-Ionen komplexieren. Es wird daher unter anderem als Therapeutikum für Silber-Vergiftungen eingesetzt. Da es freie Radikale an die Thiolgruppe bindet, wird Cystein auch zur Vorbeugung gegen Strahlenschäden eingesetzt. Bei Föten, Früh- und Neugeborenen, sowie bei Leberzirrhose ist die Aktivität des Enzyms Cystathionase nicht vorhanden oder stark eingeschränkt. In diesen Fällen ist eine exogene Cysteinzufuhr notwendig.[23] Es ist ein Radikalfänger, der die zellschädigenden Stoffe unschädlich macht und für den in neueren Studien eine gewisse Vorbeugefunktion gegen neurodegenerative Erkrankungen postuliert wird.
Bei der sehr seltenen Pantothenatkinase-assoziierten Neurodegeneration (PKAN), einer Variante der Neurodegeneration mit Eisenablagerung im Gehirn (NBIA), bewirkt eine Mutation im für das Enzym Pantothenatkinase codierende PANK2-Gen, dass es zu einer Anreicherung von Cystein-Eisen-Komplexen im Gehirn – speziell im Globus pallidus und der Pars reticulata der Substantia nigra – kommt. Dies führt wiederum zu einem Anstieg freier Radikale und letztlich zu einer oxidativen Schädigung der Nervenzellen des Gehirns.[24]
Cystein ist Bestandteil von Aminosäure-Infusionslösungen zur parenteralen Ernährung."
Zitat Ende.
Link und Quellenangabe:
6.c) Funktion von L-Glutamin
Zitat aus Wikipedia, Art. Glutamin, Aufruf vom 09.02.2025:
"Mit einem Mengenanteil von 20 % ist Glutamin Hauptbestandteil des Pools an freien Aminosäuren im Blutplasma (400–600 µmol/l).[12] Glutamin kommt in der höchsten Konzentration in den Muskelzellen (ca. 35 mmol/l) vor, die dieses auch hauptsächlich synthetisieren. Es ist unter anderem für die Wassereinlagerung in die Zelle verantwortlich und bewirkt bei körperlicher Belastung eine Vergrößerung des Zellvolumens, was als anaboles, die Proliferation unterstützendes Signal zu betrachten ist. Das heißt, die Protein- und Glykogenbildung wird gefördert.
Hyperkatabole und hypermetabole Krankheitszustände gehen mit einer deutlichen Glutaminverarmung im Blut und in der Muskulatur einher, ohne dass reaktiv die Glutaminsynthese gesteigert wird. Charakteristisch für die Reaktion auf ein Trauma oder eine Infektion ist die Reduktion freien Glutamins in der Muskulatur um etwa 50 %. Dieser Verlust intrazellulären Glutamins wurde sowohl nach selektiven Operationen, Polytraumen und Verbrennungen als auch bei Infektionen und Pankreatitis unabhängig von der Ernährung festgestellt. Glutamin stellt nicht nur einen Baustein für die Proteinsynthese, sondern u. a. auch für die Zellen des Gastrointestinaltraktes (Enterozyten, Kolonozyten) und für Leberzellen ein wichtiges Substrat dar. Daraus wurde die These entwickelt, dass Glutamin eine bedingt essentielle Aminosäure sei, die besonders bei schweren Erkrankungen notwendig ist. Entsprechend entstand die Hypothese, dass eine Glutamin-Supplementierung bei schwerkranken Patienten zu einem besseren Ergebnis führen würde.
Hingegen zeigte eine internationale multizentrische randomisierte Doppelblindstudie an über 1200 schwerkranken mechanisch beatmeten Intensivpatienten mit Multiorganversagen, die in der Verumgruppe sowohl enteral als auch parenteral Glutamin erhielten, eine signifikant erhöhte Mortalität von 32,4 % (Placebo 27,2 %) mit einem adjustierten Risikofaktor von 1,09 nach 28 Tagen. Auch nach sechs Monaten war die Mortalität unter Glutaminbehandlung signifikant höher, jedoch hatte Glutamin keinen Einfluss auf das Organversagen oder die Infektionsrate.[13] Somit erscheint eine Glutamin-Substitution in der Intensivmedizin obsolet, und in einem Kommentar wird sogar von einer „Glutamintoxizität“ gesprochen. Der verminderte Glutaminspiegel bei schwerkranken Patienten könnte somit weniger eine Folge eines Mangels als vielmehr ein positiver Adaptationsmechanismus sein.[14]
Funktion im Nervensystem
Glutamin ist chemisch eng verwandt mit der exzitatorischen Aminosäure Glutaminsäure (häufig wird nur von der ionisierten Form, dem Glutamat, gesprochen), die als Neurotransmitter bei glutamatergen Synapsen im zentralen Nervensystem vorkommt. An diesen Synapsen wird ein Teil des Glutamats nach der Ausschüttung in den synaptischen Spalt in benachbarte Gliazellen aufgenommen. Um das aufgenommene Glutamat zurück in die präsynaptischen Neuronen zu transportieren, wird es in den Gliazellen in Glutamin umgewandelt, da Glutamin keine exzitatorische Auswirkung auf die postsynaptische Membran aufweist. In den Neuronen wird Glutamin dann wieder in Glutamat umgewandelt.
Funktion in der Zellkultur von Tumorzellen
Für die Zellkultur vieler Tumorzellen ist Glutamin in hohem Überschuss notwendig. Wie bereits oben erwähnt hat das menschliche Blut eine Konzentration von 500 bis 900 µmol/l Glutamin, in der Zellkultur wird allerdings meist mit 2000–4000 µmol/l gearbeitet. Das liegt daran, dass viele Arten von Tumorzellen wesentlich mehr Glutamin aufnehmen und verstoffwechseln als normale Körperzellen.[15] Über die Gründe wird in der wissenschaftlichen Literatur zurzeit viel diskutiert. Als eine mögliche Ursache für die erhöhte Glutaminaufnahme und -abhängigkeit von Tumoren wird von verschiedenen Autoren die erhöhte Expression des Onkogens myc vorgeschlagen.[16][17] Aufgrund dieser Abhängigkeit werden und wurden verschiedene Glutaminanaloga wie DON, Azaserin oder Acivicin zur Behandlung verschiedener solider Tumoren getestet."
Zitat Ende.
Link und Quellenangabe:
6.d) Funktion von Glycin
Zitat aus Wikipedia, Art. Glycin, Aufruf vom 09.02.2025:
Nervensystem
"Glycin wirkt im Zentralnervensystem über den Glycinrezeptor als inhibitorischer Neurotransmitter, also als hemmender Signalstoff. Die Wirkung erfolgt über die Öffnung von ligandengesteuerten Chlorid-Kanälen und führt so zu einem inhibitorischen postsynaptischen Potential (IPSP), was die Aktivität der nachgeschalteten Nervenzelle herabsetzt.
Am NMDA-Rezeptor hingegen wirkt es neben dem hauptsächlichen Agonisten Glutamat an einer speziellen Glycin-Bindungsstelle stimulierend.
Glycin freisetzende Nervenzellen (glycinerge Neurone) kommen vor allem im Hirnstamm und im Rückenmark[17] vor, in letzterem hemmen sie die Aktivität der Motoneuronen des Vorderhorns, wodurch es zu einer Herabsetzung der Aktivität der von diesen Zellen innervierten Muskeln kommt.
Eine Herabsetzung der Glycinwirkung bewirken Strychnin, das als Antagonist die Bindungsstelle des Glycinrezeptors blockiert, und das Tetanustoxin, das die Ausschüttung von Glycin hemmt. Durch die Blockade der Glycinrezeptoren oder einen verminderten Glycinspiegel wird die Hemmung der Motoneuronenaktivität vermindert, sodass es zu lebensbedrohlichen Krämpfen kommen kann.
Durch abnormale Ansammlung von Glycin kann es zur Glycin-Enzephalopathie kommen."
Zitat Ende.
Link und Quellenangabe:
6.e) Funktion von Histidin
Zitat aus Wikipedia, Art. Histidin, Aufruf vom 09.02.2025:
"Der isoelektrische Punkt von Histidin befindet sich im Neutralbereich. Daher ist es die einzige proteinogene Aminosäure, die unter physiologischen Bedingungen sowohl Protonendonator als auch Protonenakzeptor sein kann. Ein Beispiel hierfür ist seine Rolle in der „katalytischen Triade“ (Asp-His-Ser) von Serinproteasen. Im Proteinanteil des sauerstofftransportierenden Blutfarbstoffs Hämoglobin wie des sauerstoffspeichernden Muskelfarbstoffs Myoglobin sind das „distale“ und das „proximale“ Histidin der Peptidkette von besonderer Bedeutung für den Bindungsplatz des Eisens der prosthetischen Häm-Gruppe. Histidin tritt auch als Ligand von Metallionenkomplexen der Elektronentransportketten auf in den Mitochondrien (oxidative Phosphorylierung) und in den Chloroplasten (Photosynthese)."
Zitat Ende.
Link und Quellenangabe:
6.f) Funktion von Isoleucin
Zitat aus Wikipedia, Art. Isoleucin, Aufruf vom 09.02.2025:
"Einerseits wird Isoleucin als Baustein für den Proteinaufbau benötigt. Andererseits kann es auch zur Energiegewinnung in Muskelzellen dienen. Das spielt bei proteinreicher Kost eine Rolle oder aber bei längeren Anstrengungen und in Hungerphasen, wenn der Körper auf eigene Reserven zurückgreift. Der Abbau von Isoleucin liefert Acetyl-CoA und Propionyl-CoA.[9]
Die Einschätzungen des Tagesbedarfs für gesunde Erwachsene reichen, je nach verwendeter Methode, von 7,5 bis 28 mg Isoleucin pro Kilogramm Körpergewicht.[10] Im menschlichen Organismus kommt Isoleucin fast nur in gebundenem Zustand vor. Die Konzentration von freiem Isoleucin im Blut beträgt rund 7 mg/l, über den Urin werden pro Tag 10 bis 15 mg ausgeschieden."
Zitat Ende.
Link und Quellenangabe:
6.g) Funktion von L-Leucin
Zitat aus Wikipedia, Art. L-Leucin, Aufruf vom 09.02.2025:
"L-Leucin ist wichtig für den Erhalt und Aufbau von Muskelgewebe. Es unterstützt die Proteinbiosynthese in Muskulatur und Leber, hemmt den Abbau von Muskelprotein und unterstützt Heilungsprozesse. Wie L-Isoleucin kann auch L-Leucin als Energielieferant dienen.
Die Einschätzungen des Tagesbedarfs für gesunde Erwachsene reichen, je nach verwendeter Methode, von 10 bis 50 mg Leucin pro Kilogramm Körpergewicht.[16] Ein Mangel ist entweder durch ungenügende Zufuhr mit der Nahrung oder Unterversorgung mit Vitamin B6 bedingt."
Zitat Ende.
Link und Quellenangabe:
6.h) Funktion von Lysin
Zitat aus Wikipedia, Art. Lysin, Aufruf vom 09.02.2025:
"Lysin ist eine der Aminosäuren, die bevorzugt posttranslational modifiziert werden. Dabei kann die Ladung erhalten bleiben (mono- und di-Methylierung) oder verschwinden (Acetylierung). Im Kollagen wurde ein modifiziertes Lysin gefunden, das Hydroxylysin mit einer OH-Gruppe in der Seitenkette, katalysiert unter Mitwirkung des Enzyms Lysylhydroxylase und des Cofaktors Ascorbinsäure (Vitamin C). Hydroxylysin erlaubt die nachfolgende O-Glykosylierung des Kollagenmoleküls im Endoplasmatischen Retikulum und Golgi-Apparat. Die Glykosylierung bestimmt die Packungsdichte dieses wichtigen Bindegewebeproteins und wird auch mit der Steuerung der Kollagenabgabe aus der Zelle (Exozytose) in Verbindung gebracht.
Eine herausragende Bedeutung haben die Aminosäure Lysin und ihre methylierten Formen bei der Histonmodifikation. Speziell die Lysin-Reste am Histon 3 und 4 sind die bevorzugten Substrate von Histon-modifizierenden Enzymen (Histon-Acetyltransferasen, Histon-Deacetylasen, Histon-Methyltransferasen, Histon-Demethylasen). Durch die dadurch erfolgte Lysin-Acetylierung oder Lysin-Methylierung (oft an mehreren Stellen im Molekül) ändert sich die elektrostatische Wechselwirkung zwischen den Histonen und der genomischen DNA, wodurch bei letzterer der Zugang von Transkriptionsfaktoren und DNA-modifizierenden Enzymen reguliert wird. Diese Histon-Lysin-Modifikationen sind damit ein wesentlicher, molekularer Mechanismus der epigenetischen Gen-Regulation.
Eine weitere Modifikation ist die Ubiquitinierung in Proteinen, die damit für den Abbau durch das Proteasom markiert werden.
Beim Abbau des Lysins (Eiweißfäule) entsteht durch Decarboxylierung das Leichengift Cadaverin."
Zitat Ende.
Link und Quellenangabe:
6.i) Funktion von Methionin
Zitat aus Wikipedia, Art. Methionin, Aufruf vom 09.02.2025:
"Bei der Verstoffwechselung von überschüssigem Methionin wird der in der Substanz enthaltene Schwefel zu Schwefelsäure oxidiert und über die Nieren ausgeschieden, wodurch der Harn angesäuert wird. Der Mechanismus der Harnansäuerung kann bei einigen Erkrankungen die Heilung unterstützen.
Therapeutisch wird L-Methionin verwendet zur:
- Optimierung der Wirkung von Antibiotika mit Wirkungsoptimum im sauren Urin (pH 4–6): z. B. Ampicillin, Carbenicillin, Nalidixinsäure, Nitrofurane
- Vermeidung der Neubildung von Nierensteinen (bei Phosphatsteinen wie Struvit, Carbonatapatit, Brushit)
- Hemmung des Bakterienwachstums bei einer Blasenentzündung
- Bestandteil von Infusionslösungen zur parenteralen Ernährung.[27]
In der Diagnostik wird es in Form von 11C-S-Methyl-L-Methionin als Radiopharmakon zur Darstellung von Hirntumoren bei der Positronen-Emissions-Tomographie benutzt."
Zitat Ende.
Link und Quellenangabe:
6.j) Funktion von L-Phenylalanin
Zitat aus Wikipedia, Art. Phenylalanin, Aufruf vom 09.02.2025:
"Für Menschen ist L-Phenylalanin eine essentielle Aminosäure, die im Stickstoffstoffwechsel eine wichtige Rolle spielt. In der Leber kann L-Phenylalanin – wenn ausreichend vorhanden – zu L-Tyrosin umgewandelt werden. Dies wird durch die Phenylalaninhydroxylase, einer Monooxygenase, katalysiert. Das Reduktionsmittel hierbei ist Sapropterin.
Reicht die Menge L-Phenylalanin jedoch nicht aus, muss Tyrosin auch mit der Nahrung aufgenommen werden. Da bei starkem Stress dieser Mechanismus nicht mehr funktioniert, muss L-Tyrosin in solchen Fällen verstärkt aufgenommen werden. Die normale tägliche Dosis sollte 14 mg/kg Körpergewicht (eines Erwachsenen) betragen. Sie wird grundsätzlich ausreichend durch die Nahrung gedeckt (siehe auch oben). Bei übermäßigem Verzehr kann Phenylalanin abführend wirken.
L-Phenylalanin ist beteiligt an der Synthese von Adrenalin, Noradrenalin, L-Dopa, PEA und Melanin.
Die Aminosäure L-Phenylalanin dient als Ausgangsstoff für viele weitere Stoffe, z. B. für den Botenstoff Dopamin.
Racemische Gemische aus D- und L-Phenylalanin (DLPA) werden als Schmerzmittel oder auch bei Depressionen verabreicht. Sie wirken stimmungsaufhellend. Die vermutete schmerzstillende Wirkung von DL-Phenylalanin lässt sich durch die mögliche Blockade des Enkephalin-Abbaus von D-Phenylalanin durch das Enzym Carboxypeptidase A erklären.[14] Damit ist dies eines der seltenen Beispiele für metabolische Wirkungen von D-Enantiomeren. Eine genetisch bedingte Stoffwechselstörung ist Phenylketonurie (PKU), hier wird L-Phenylalanin im Körper nicht vollständig abgebaut. Die Erkrankten vertragen nur einen Bruchteil der üblichen Zufuhr phenylalaninhaltiger Nahrungsmittel. Das betrifft vor allem natürliches Eiweiß, aber auch synthetisch hergestellte Substanzen, wie z. B. den Süßstoff Aspartam. An PKU erkrankten Menschen fehlt das Enzym Phenylalaninhydroxylase. Es wandelt beim gesunden Menschen L-Phenylalanin in L-Tyrosin um. Fehlt das Enzym, steigt die Konzentration an L-Phenylalanin im Blut auf ein zu hohes Niveau an. Dies wirkt sich auf Reifung und Funktion des Gehirns ungünstig aus. Daneben können auch entzündliche Prozesse[15] die Aktivität des Enzyms schwächen und zu moderater Hyperphenylalaninämie führen."
Zitat Ende.
Link und Quellenangabe:
6.k) Funktion von L-Prolin
Zitat aus Wikipedia, Art. Prolin, Aufruf vom 09.02.2025:
"L-Prolin wird im menschlichen Körper z. B. für die Bildung von Kollagen, dem Protein, aus dem Bindegewebe und Knochen bestehen, benötigt. Ferner wird es als „Helixbrecher“ bezeichnet und findet sich oft am Übergang einer Alpha-Helix zu einer anderen Sekundärstruktur (häufig Random Coil) wieder. Prolin ist nämlich die einzige Aminosäure, deren Peptidbindung kein Wasserstoffatom aufweist. Folglich kann es sich nicht an der Bindung von Wasserstoffbrückenbindungen beteiligen.
L-Prolin wird in der Ökotoxikologie als Biomarker verwendet, z. B. für Trockenstress, Salzstress, da es von Pflanzen vermehrt produziert wird, wenn der Wasserhaushalt unter Stress gerät. L-Prolin als zyklische Aminosäure wirkt als Puffer gegen manche Ionen, die ansonsten die Enzymtätigkeiten im Cytoplasma einschränken könnten."
Zitat Ende.
Link und Quellenangabe:
6.l) Funktion von L-Tryptophan
Zitat aus Wikipedia, Art. Tryptophan, Aufruf vom 09.02.2025:
"Als Bestandteil von Nährlösungen zur parenteralen Ernährung findet L-Tryptophan, neben anderen Aminosäuren, breite Anwendung. Die essentiellen Aminosäuren inklusive Tryptophan sind in solchen Lösungen immer enthalten.[19]
Als schlichte Nahrungsergänzung ist L-Tryptophan nur bei gesichertem Mangel sinnvoll, der in Industrieländern praktisch unbekannt ist. Bei einer Fruktosemalabsorption ist jedoch ein signifikant erniedrigter Serumtryptophanspiegel beobachtet worden.[20] Der Spiegel dieser essentiellen L-Aminosäure in der Nährflüssigkeit des Gehirns ist nicht beliebig durch Verzehr entsprechend eiweißhaltiger Nahrung einstellbar, denn L-Tryptophan konkurriert mit fünf anderen Aminosäuren an der Blut-Hirn-Schranke um das Eindringen in die Nährflüssigkeit des Gehirns; nämlich mit den verzweigtkettigen (das sind L-Valin, L-Leucin und L-Isoleucin) und zwei aromatischen (L-Phenylalanin und L-Tyrosin) Aminosäuren.[21]
Verwendung als Antidepressivum
Die Wirkung von L-Tryptophan wird oft als stimmungsaufhellend, beruhigend und gewichtsreduzierend beschrieben. L-Tryptophan gilt als „natürliches Antidepressivum“, ihm wird eine gewisse Wirksamkeit bei depressiven Erkrankungen bei gleichzeitig geringen Nebenwirkungen nachgesagt. Wissenschaftliche Belege einer Wirkung durch zusätzliche Tryptophangaben (z. B. als Nahrungsergänzungsmittel) fehlen jedoch.[22] L-Tryptophan ist in Deutschland zur Behandlung depressiver Erkrankungen nicht zugelassen. Als mildes Schlafmittel dürfen Tryptophan-haltige Arzneimittel ohne Rezept abgegeben werden (erhältlich als Tabletten mit 500 mg L-Tryptophan in variablen Packungsgrößen). Die Kennzeichnung der Packung muss vor der Einnahme durch Schwangere, Stillende sowie Kinder und Jugendliche warnen, auf die mögliche Beeinträchtigung der Fahrtüchtigkeit hinweisen und vor der Einnahme die Rücksprache mit einem Arzt oder Therapeuten nahelegen.[23] In Österreich ist L-Tryptophan rezeptpflichtig, in der Schweiz ist es als Nahrungsergänzungsmittel bis 240 mg Tageshöchstdosis[24] weder rezept- noch apothekenpflichtig.
Die stimmungsaufhellende Wirkung von L-Tryptophan beruht dabei vermutlich darauf, dass es im menschlichen Körper zu Serotonin umgewandelt wird. Es wird angenommen, dass durch einen erhöhten Serotoninspiegel die Stimmung aufgehellt und Depressionen gelindert werden können. Sollte Tryptophan zusätzlich in Form von Nahrungsergänzungsmitteln aufgenommen werden, auch zusammen mit Medikamenten, die den Serotoninspiegel weiter erhöhen, kann das sogenannte Serotoninsyndrom auftreten.[22] Als Nebenwirkungen sind hierbei zahlreiche Symptome wie z. B. Blutdruckanstieg (in schweren Fällen Koma und Schock), Hyperthermie, Schwitzen, Zittern, Myoklonie, Unruhe oder Durchfall bekannt.[25][22] Die Plasmahalbwertszeit beträgt 2 ± 0,1 Stunden; bei Lebererkrankungen wie Leberzirrhose kann diese auf 4,7 ± 0,4 h ansteigen.[26]
Zu einer Überdosierung von L-Tryptophan kommt es nur schwerlich, da L-Tryptophan selbst der Hauptaktivator seines abbauenden Enzyms Tryptophan-Pyrrolase (genauer: Tryptophan-2,3-Dioxygenase, EC 1.13.11.11) ist. Ein weiterer Aktivator ist Cortisol. Dies liefert auch eine Erklärung dafür, dass Stress (und der dadurch erhöhte Cortisolspiegel) zu einem verminderten Umsatz von L-Tryptophan zu 5-HTP führt. Nicotinsäure (Vitamin-B3) hingegen hemmt die Aktivität des Enzyms und fördert so den Umsatz von L-Tryptophan zu 5-HTP. Tryptophan-Pyrrolase baut L-Tryptophan unter Sauerstoffverbrauch zu N-Formyl-L-Kynurenin ab, welches in weitere Stoffe umgewandelt werden kann (u. a. Nicotinsäure). Dies ist auch der Hauptstoffwechselweg von L-Tryptophan (nur etwa 3 % wird zu 5-HTP bzw. Serotonin umgewandelt). Dabei fungiert Häm (Eisen) als Cofaktor. Einer Erhöhung der Zufuhr von L-Tryptophan steht ab einer gewissen Grenze eine überproportionale Aktivierung der Tryptophan-Pyrrolase gegenüber, so dass im Ergebnis mehr L-Tryptophan abgebaut wird, als zusätzlich zugeführt worden ist."
Zitat Ende.
Link und Quellenangabe:
6.m) Funktion von Tyrosin
Zitat aus Wikipedia, Art. Tyrosin, Aufruf vom 09.02.2025:
"Tyrosin ist ein Vorläufer von Neurotransmittern, insbesondere Dopamin und Noradrenalin. Durch vermehrte Zufuhr von Tyrosin kann deren Synthese vorübergehend deutlich gesteigert werden, für etwa eine halbe Stunde.[14] Auf die Stimmungslage hat dies aber nur geringen Einfluss.[15][16][17][18][19][20] Der für die Umwandlung im Stoffwechsel geschwindigkeitsbestimmende Schritt wird durch die Tyrosinhydroxylase katalysiert und limitiert, weshalb die Effekte geringer als bei Zufuhr von L-DOPA ausfallen. Aus Tierversuchen ist bekannt, dass deren Enzymaktivität bei hohen Dosen von Tyrosin durch Substratüberschusshemmung stark abnimmt, sodass der Dopaminspiegel absinkt.[21][22]
Einige Studien fanden einen Nutzen unter Stressbelastung, Kälte oder Übermüdung.[23][24][25][26][23][16][27][28] Eine Steigerung des Leistungsvermögens im Ausdauersport (anderthalbstündiges Radfahren) durch Tyrosinaufnahme konnte nicht festgestellt werden, hingegen durch Kohlenhydrataufnahme.[18]
Die diätetische Zuführung von L-Tyrosin dient als Substitutionstherapie oder Supplementation bei Mangel, so z. B. bei Phenylketonurie, da ansonsten eine Unterproduktion von Melanin (Albinismus) und L-Thyroxin (Kretinismus) resultiert. Zudem können Probleme bei der Herstellung von Katecholaminen bestehen.
Daneben wird L-Tyrosin aufgrund seiner Protein-adsorbierenden Eigenschaften seit Jahren als adjuvanter Depotträger bei der spezifischen Subkutanen Immuntherapie (SCIT) eingesetzt.
L-Tyrosin zeichnet sich gegenüber anderen Depotträgern wie Aluminiumhydroxid oder Calciumphosphat dabei unter anderem durch den Vorteil der vollständigen Metabolisierbarkeit und eine geringere Halbwertszeit von 48 Stunden an der Injektionsstelle aus."
Zitat Ende.
Link und Quellenangabe:
6.n) Funktion von Valin
Zitat aus Wikipedia, Art. Tyrosin, Aufruf vom 09.02.2025:
"Valin wird als Baustein zur Proteinbiosynthese benötigt, ist aber bei proteinreicher Kost oder im Falle der Mobilisierung körpereigener Proteinreserven auch zur Energiegewinnung nutzbar. Beispielsweise dient Valin, wie die beiden anderen Aminosäuren mit verzweigter Kohlenstoffkette Leucin und Isoleucin, der Ernährung des Muskels. Das spielt eine Rolle bei längerer Anstrengung oder in Hungerphasen, wenn der Körper auf eigene Reserven zurückgreifen muss. Der Abbau von Valin liefert Propionyl-CoA, das nach Umsetzung zu Succinyl-CoA zur Auffüllung des Citratzyklus beiträgt."
Zitat Ende.
Link und Quellenangabe:
7.) Wann liegt ein Mangel vor? (Anzeichen für Aminosäuremangel)
Zitat:
"Ein Aminosäurenmangel liegt vor, wenn der Körper nicht genügend Aminosäuren erhält (gilt für essenzielle Vertreter) oder synthetisieren kann (bei nicht-essenziellen Vertretern), um seinen Bedarf zu decken.
Mögliche Ursachen sind eine unausgewogene Ernährung, verschiedene Erkrankungen (z.B. chronische Darmerkrankungen) und bestimmte gesundheitliche Bedingungen - wie etwa eine Schwangerschaft, wo der Proteinbedarf erhöht ist. Auch bei Frauen nach den Wechseljahren (Menopause) ist ein erhöhter Bedarf an Aminosäuren bekannt.
Die Auswirkungen eines Aminosäurenmangels können vielfältig sein. Entscheidend ist, welche Aminosäure in welchem Ausmaß fehlt. Mögliche Anzeichen sind:
- Appetitmangel und Erbrechen
- Beeinträchtigungen bei Aufnahme, Transport und Speicherung von Nährstoffen
- neurologische Symptome durch verringerte Bildung von Nervenbotenstoffen (Neurotransmittern)
- emotionale Störungen wie Launenhaftigkeit, schwere Depressionen und Angstzustände
- Reizbarkeit und Schlaflosigkeit
- Blutarmut (Anämie) und reduzierter Sauerstofftransport
- hormonelle Ungleichgewichte, z.B. Mangel an Insulin, Wachstumshormon oder Schilddrüsenhormonen im Plasma
- Wachstumsverzögerung bei jungen Menschen
- beeinträchtigte Entwicklung (einschließlich kognitive Entwicklung) bei jungen Menschen
- reduzierter Gesamtenergieverbrauch des Körpers und erhöhte Ansammlung von weißem Fettgewebe
- Muskelschwund
- körperliche Erschöpfung und Schwäche
8.) Wann sind die Aminosäuren erhöht?
Ein Überschuss an bestimmten Aminosäuren kann verschiedene Ursachen haben, darunter:
Stoffwechselstörungen: Ein Beispiel ist die Phenylketonurie. Betroffenen fehlt ein Enzym, das die Aminosäure Phenylalanin abbaut. Das führt zu einem Anstieg von Phenylalanin im Blut. Unbehandelt kann das Schäden am Nervensystem verursachen.
Ähnlich führt die Maple-Syrup-Urine-Krankheit durch einen Enzymmangel zu einer Anhäufung von Leucin, Isoleucin und Valin. Als Folge treten neurologische Symptome und ein charakteristischer Uringeruch auf.
Nierenfunktionsstörung: Die Nieren spielen eine entscheidende Rolle bei der Ausscheidung von Aminosäuren und deren Abbauprodukten. Bei einer Nierenfunktionsstörung können diese Prozesse beeinträchtigt sein, was zu einer Anhäufung von Aminosäuren im Blut führt.
Lebererkrankungen: Die Leber ist maßgeblich an der Verstoffwechslung von Aminosäuren beteiligt. Bei Lebererkrankungen wie Hepatitis oder alkoholbedingten Leberschäden kann die Fähigkeit des Organs, Aminosäuren zu verarbeiten und umzuwandeln, beeinträchtigt sein – ein Ungleichgewicht im Aminosäureprofil entsteht.
Verletzungen wie schwere Verbrennungen beeinflussen ebenfalls den Aminosäuren-Stoffwechsel, da der Körper unter solchen Bedingungen oft einen erhöhten Proteinbedarf hat. Wenn der Bedarf nicht gedeckt wird, beginnt der Körper, körpereigene Proteine abzubauen. Dann gelangen sehr viele Aminosäuren ins Blut."
Zitat Ende.
Link und Quellenangabe:
9.) Aminogramm: Was sind Normwerte für Aminosäuren?
Zitat:
"Ein Aminogramm ist das Laborergebnis über die Bestimmung aller 23 essenziellen und nicht essenziellen Aminosäuren im Blut / Serum. Wir bieten ein solches Aminogramm an, das so genannte Aminosäuren-Komplettprofil. In einem Aminogramm werden die Messwerte der Laboranalyse im Vergleich zu den Normwerten dargestellt."
Zitat Ende.
Link und Quellenangabe:
Zitat:
"Die verschiedenen Aminosäuren lassen sich unter anderem im Blutplasma sowie Urin bestimmen. Sie hängen vom Alter ab.
Achtung: Die Normwerte können sich von Labor zu Labor unterscheiden.
Gegebenenfalls gelten die auf Ihrem Laborbefund angegebenen Normwerte.
Aminosäuren-Normwerte im Blutplasma
Die Messwerte im Blutplasma sind in der Einheit Mikromol pro Liter angegeben.
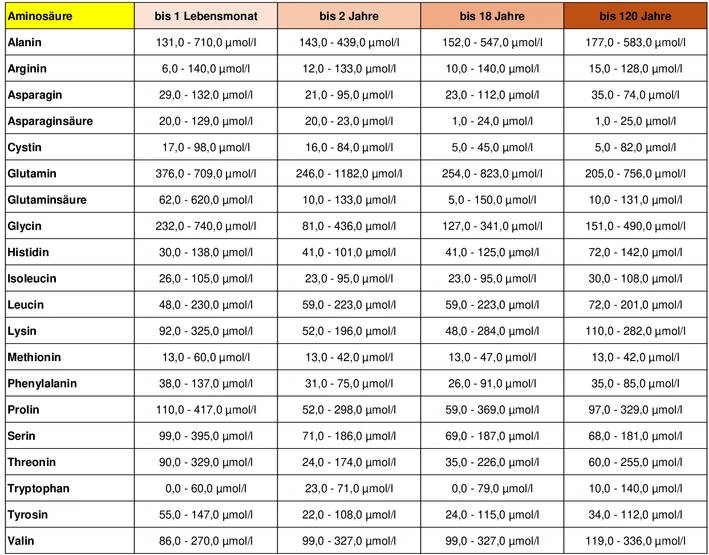
Zitat Ende.
Link und Quellenangabe:
10.) Wann bestimmt man Aminosäuren-Werte?
Zitat:
"In folgenden Situationen bestimmen Mediziner die Aminosäuren-Werte:
Verdacht auf Stoffwechselerkrankungen: Besonders bei Neugeborenen ist eine Aminosäure-Bestimmung zur Diagnose von Krankheiten wie Phenylketonurie wichtig (zum Beispiel, wenn ein Baby Entwicklungsverzögerungen zeigt).
Bewertung des Ernährungsstatus: Bei Patienten, die über eine Infusion ernährt werden, bestimmt man Aminosäure-Werte, um den Ernährungszustand zu überprüfen. So lässt sich die Ernährungslösung je nach Bedarf anpassen.
Aminosäure-Ausscheidung mit dem Urin (Aminoazidurie): Aminosäuren werden auch zur Überwachung bestimmt, wenn Patienten krankheitsbedingt über den Urin bestimmte Aminosäuren verlieren (zum Beispiel bei Homocystinurie oder Zystinurie).
Verdacht auf Vergiftung: Aminosäuren bestimmt man zudem bei Verdacht auf eine toxische Substanzaufnahme wie einer Überdosis von Medikamenten, die den Aminosäure-Stoffwechsel beeinflussen.
Einschätzung von verringerter Nährstoffaufnahme (Malabsorption) und Verdauungsstörungen: Ein weiterer Anlass für eine Aminosäure-Messung sind Erkrankungen wie Zöliakie oder Morbus Crohn, wo der Darm möglicherweise nicht in der Lage ist, bestimmte Nährstoffe und Aminosäuren effektiv aufzunehmen.
Einschätzung von Nierenerkrankungen: Zum Beispiel bei Patienten mit chronischer Niereninsuffizienz prüft man, inwieweit die Fähigkeit der Nieren zur Verarbeitung und Ausscheidung von Aminosäuren beeinträchtigt ist."
Zitat Ende.
Link und Quellenangabe.
11.) Wann ist die Einnahme von Aminosäuren sinnvoll?
Zitat:
"Wer Aminosäuren gerne in flüssiger Form zu sich nehmen möchte, kann dies in natürlicher Form zum Beispiel mit Milch machen. Sie enthält Leucin und Phenylalanin.
Vor allem unter Sportlern und Sportlerinnen weit verbreitet sind aber Getränke mit viel Aminosäuren in Form von Nahrungsergänzungsmitteln. Da durch körperliche Anstrengungen wie Training oder Wettkampf der Gehalt an einigen Aminosäuren absinkt, sollen solche Nahrungsergänzungsmittel die Speicher wieder füllen. Sie gibt es als Riegel oder Kapseln.
Außerdem soll die isolierte Zufuhr von sogenannten verzweigtkettigen Aminosäuren (BCAA), zu denen Leucin, Isoleucin und Valin zählen, die Muskelermüdung verzögern. Das ist wissenschaftlich aber nicht belegt.
Grundsätzlich ist es nicht notwendig, isolierte Aminosäuren als Nahrungsergänzung einzunehmen. Selbst Ausdauersportler, die einen erhöhten Bedarf haben, schaffen es bei ausgewogener Ernährung, essenzielle Aminosäuren in ausreichender Menge über die Nahrung aufzunehmen. Sollten Sie dennoch welche verwenden, achten sie auf die vom Hersteller empfohlenen Tagesmengen.
Eine hohe zusätzliche Zufuhr an einzelnen Aminosäuren ruft eventuell unerwünschte Wirkungen hervor zum Beispiel kann Übelkeit auftreten oder Durchfall. Auch der Harnsäurewert im Körper kann sich erhöhen, wenn die überschüssigen Aminosäuren abgebaut werden müssen. Die möglichen Folgen: Gicht sowie mögliche Schäden von Leber und Nieren durch übermäßige Belastung.
Sinnvoll jedoch kann es sein, isolierte Aminosäuren einzunehmen bei bestimmten Krankheiten, bei Mangelernährung und in Phasen, in denen der Körper es nicht schafft, die sogenannten konditionellen essenziellen Aminosäuren in ausreichender Menge herzustellen.
Auch in den Wechseljahren kommen mitunter Aminosäuren als Ergänzung zum Einsatz: ß-Alanin oder Arginin zum Beispiel. Sie sollen gegen Hitzewallungen helfen, allerdings ist das wissenschaftlich nicht abschließend gesichert.
Was hingegen sicher ist: Aminosäuren zuführen sollten Sie keinesfalls auf gut Glück.
Lassen Sie sich vorher von einem Arzt oder einer Ärztin untersuchen und beraten. So können Sie die richtige Dosierung für Ihre Bedürfnisse feststellen."
Zitat Ende.
Link und Quellenangabe:
12.) Was ist zu beachten?
Zitat:
"Von natürlichen Aminosäuren sind kaum Nebenwirkungen bekannt. Wer viel Proteine isst, bekommt eventuell Blähungen oder Durchfall.
Einzelne Aminosäuren haben wenig Nutzen. Achten Sie deshalb darauf, dass Sie möglichst ausgewogen alle neun essenziellen Aminosäuren zu sich nehmen, um ein ausbalanciertes Aminosäureprofil im Körper zu schaffen. Dazu eignen sich gesunde, proteinreiche Lebensmittel – am besten hauptsächlich pflanzliche.
Wenn Arzt oder Ärztin Ihnen empfehlen, Aminosäuren isoliert zuzuführen, weisen Sie ihn oder sie auf Medikamente hin, wenn Sie welche einnehmen. Aminosäuren können Wechselwirkungen mit verschiedenen Arzneimitteln eingehen und deren Wirkung verstärken oder abschwächen. Die essenzielle Aminosäure Methionin kann beispielsweise die Wirkung von Parkinson-Medikamenten mit dem Wirkstoff L-Dopa mindern."
Zitat Ende.
Link und Quellenangabe:
13.) Aminosäuren zum Abnehmen
Zitat:
"Aminosäuren werden oft als Fatburner beworben. Klingt zunächst plausibel: L-Carnitin, das der Körper aus Lysin und Methionin zusammensetzt, spielt zum Beispiel eine wichtige Rolle im Fettstoffwechsel.
Tatsächlich scheint sich die Zusammensetzung an essenziellen Aminosäuren im Körper zu verändern, je nachdem, ob jemand normal- oder übergewichtig ist. Es könnte also sein, dass sich Aminosäuren in der Therapie von Übergewicht und Adipositas einsetzen lassen.
Allerdings ist die Studienlage zum Thema Aminosäuren und deren Wirkung beim Abnehmen noch recht dünn. Häufig handelt es sich um Untersuchungen mit Mäusen oder Ratten. Laut aktuellem wissenschaftlichem Stand hat beispielsweise eine zusätzliche Einnahme isolierten L-Carnitins keinen direkten Einfluss auf den Fettanteil und die Geschwindigkeit der Fettverbrennung des Körpers, da dieser den Überschuss einfach ausscheidet.
Wissenschaftler vermuten vielmehr, dass es beim Abnehmen um das optimale Zusammenspiel aller essenziellen Aminosäuren geht. Das lässt sich derzeit wohl noch am besten durch eine ausgewogene Ernährung herstellen.
Aminosäuren sind deshalb notwendig, um gesund Gewicht zu verlieren. Keinesfalls aber sind sie ein Wundermittel oder eine Abkürzung zum Wunschgewicht."
Zitat Ende.
14.) Über die NetDoktor-Autoren
15.) Weitere Informationen:
Allgemein (Gruppe 1)
Allgemein (Gruppe 2)
Allergien - wenn der Körper rebelliert | Doku HD Reupload | ARTE"
3. Schlussteil / Abschließendes
Wer von Euch nimmt Metformin?
Metformin ist ein Medikament, das bei Diabetes eingesetzt wird.
Wenn man sich die Strukturformel von Metformin anschaut (zum Beispiel über die Gelbe Liste), stellt man fest, dass Metformin auffälligerweise ähnliche Strukturen hat wie Aminosäuren (zum Beispiel der NH2-Abschnitt ist ähnlich).
Aus einer 2009 veröffentlichten Studie:
"Aminosäureunterstützung bei der Prävention von Diabetes und diabetischen Komplikationen" - PubMed
Zitat:
Abstrakt
"Neue Erkenntnisse legen nahe, dass Aminosäuren möglicherweise eine wichtige Rolle bei der Prävention von Diabetes und diabetesbedingten Schwierigkeiten spielen. Zu den an der Pathogenese diabetischer Erkrankungen beteiligten Signalwegen gehören ein erhöhter Polyol-Signalweg-Fluss, eine erhöhte Bildung fortgeschrittener Glykationsendprodukte, die Aktivierung der Proteinkinase C sowie oxidativer und Carbonylstress. In dieser Übersicht werden die modulatorischen Effekte von Aminosäuren auf die Insulinsekretion und ihre Wirkung im Zusammenspiel mit Insulin als Signalmoleküle erläutert. Auch Belege für die Rolle einiger Aminosäuren bei der Kontrolle der Glykämie und durch Glukose ausgelöster pathologischer Signalwege werden dargelegt. Einzelne Aminosäuren, insbesondere solche mit antioxidativer Wirkung wie N-Acetylcystein und Taurin, scheinen durch ihre Fähigkeit, die Entstehung von intrazellulärem oxidativem Stress und die Glykooxidation zu verringern, positive Effekte zu haben. Andere Aminosäuren wie Glycin und Lysin könnten gute Kandidaten für die Prävention von Glykation sein. Eine Ernährungsintervention mit Taurin, Phenylalanin oder verzweigtkettigen Aminosäuren kann die Insulinempfindlichkeit und die postprandiale Glukoseausscheidung verbessern. Bei Diabetes wurde ein Mangel an einer oder mehreren Aminosäuren beobachtet, und die positiven Auswirkungen von Aminosäuren korrelierten in einigen Studien positiv mit dem Anstieg des Plasmaspiegels mehrerer Aminosäuren. Die Einbeziehung einzelner Aminosäuren/-mischungen, möglicherweise als Kombinationstherapie mit herkömmlichen Behandlungsprotokollen, könnte von therapeutischem Interesse sein."
Zitat Ende.
Link und Quellenangabe:
Aminosäuren "Wirkung, Mangel & Ernährung" | MeinMed.at
Rainer Langlitz
2 Rezensionen






